Questão sobre Cinética Química: Energia de Ativação
Fonte: ESPCEX
Disciplina Química
Química
BNCC 'EM13CNT101'
'EM13CNT101'
Assunto Cinética Química: Energia de Ativação
Cinética Química: Energia de Ativação
Dificuldade Difícil
Difícil
(ESPCEX 2010) - Questão Difícil de Química
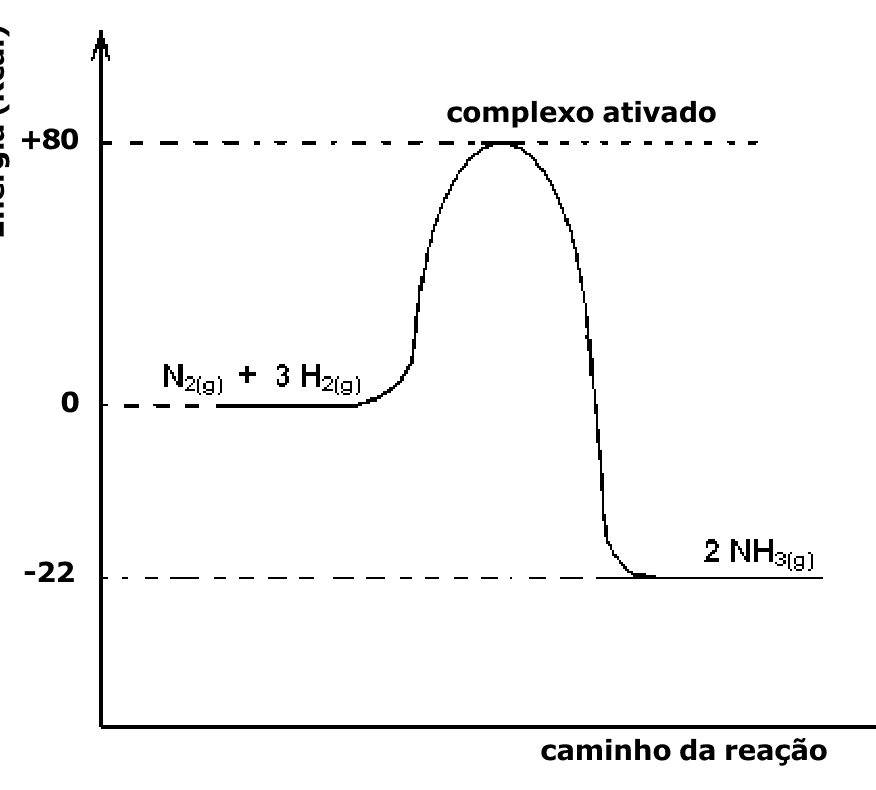
a.
b.
c.
d.
e.
Gabarito
A questão envolve a interpretação de um gráfico de energia de uma reação química. A afirmação II é correta, pois a energia de ativação é a energia necessária para iniciar uma reação, e pode ser obtida a partir do gráfico. A afirmação I é incorreta, pois a energia envolvida por um mol de NH3 formado é a diferença entre a energia dos reagentes e a energia dos produtos, que não é fornecida. A afirmação III também é incorreta, pois a reação é exotérmica (libera energia), não endotérmica (absorve energia). Portanto, a alternativa correta é 'apenas II'.
Está montando uma prova ou lista de exercícios?
Na plataforma da Teachy é possível gerar esses materiais automaticamente, sem perder horas buscando por questões 😉
Quem viu essa questão também gostou de...
Questão
Questão
Dificuldade Fácil
Fonte:
Teachy
Reações: Balanceamento • 'EM13CNT101'
Dificuldade Fácil
Questão
Questão
Dificuldade Fácil
Fonte:
UFTM
Reações: Balanceamento de Equação Redox • 'EM13CNT101'
Dificuldade Fácil
Questão
Questão
Dificuldade Difícil
Fonte:
Teachy
Leis ponderais: Proust • 'EM13CNT101'
Dificuldade Difícil
Questão
Questão
Dificuldade Médio
Fonte:
Teachy
Soluções: Introdução
Dificuldade Médio
Faça parte de uma comunidade de professores direto no seu WhatsApp
Conecte-se com outros professores, receba e compartilhe materiais, dicas, treinamentos, e muito mais!
2025 - Todos os direitos reservados